Синдром відміни антидепресантів не є рідкісним явищем і може значно ускладнити повсякденне життя. У статті …
Продовжити читання

Синдром відміни антидепресантів не є рідкісним явищем і може значно ускладнити повсякденне життя. У статті …
Продовжити читання
Синдром відміни антидепресантів не є рідкісним явищем і може значно ускладнити повсякденне життя. У статті розглянемо, чому виникає цей синдром, які його симптоми, скільки триває, як пережити його без шкоди для здоров’я та як полегшити …
Продовжити читання
Обсесивно-компульсивний розлад — це психічний стан, що порушує якість життя людини. Він характеризується нав’язливими думками (обсесіями) та повторюваними діями (компульсіями), які важко контролювати. Людина розуміє ірраціональність цих дій, але не може припинити їх виконання. У …
Продовжити читання
Серце — головний мотор людського тіла. Його стан безпосередньо залежить від того, що ми їмо. У сучасному світі, де стрес, малорухомий спосіб життя та швидка їжа стали нормою, питання вибору правильного харчування набуває особливої ваги. …
Продовжити читання
Укол в живіт — це підшкірна ін’єкція, яка проводиться в область навколо пупка. У цій статті розглянемо, як правильно колоти, для чого призначають такі ін’єкції, і на що звернути увагу, щоб процедура була безпечною та …
Продовжити читання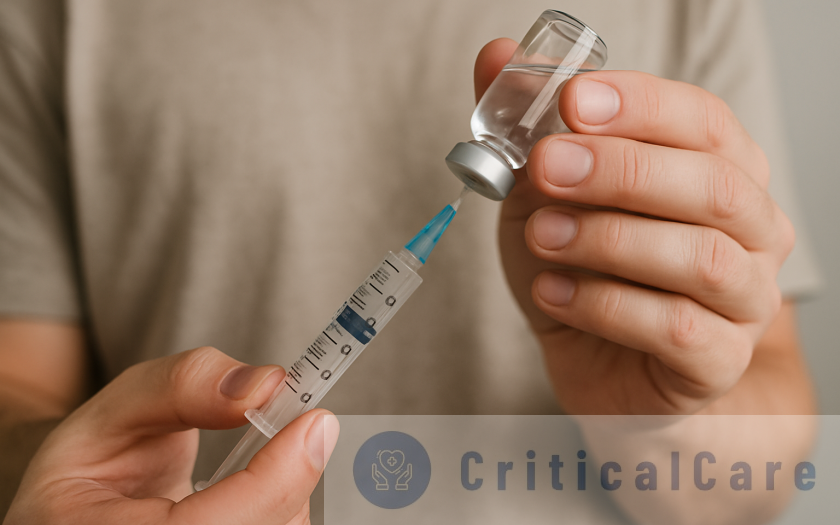
Чому важливо знати, як правильно робити укол в сідницю Ін’єкції — ефективний спосіб введення ліків, особливо коли потрібно діяти швидко або обійти травну систему. Укол в сідницю залишається найпоширенішим методом внутрішньом’язового введення. Здавалося б, нічого …
Продовжити читання
Що таке гіпертонія і чому її важливо лікувати Ліки від гіпертонії, або підвищеного артеріального тиску, є одним із найпоширеніших запитів у світі. Підступність хвороби полягає в тому, що тривалий час вона може протікати без явних …
Продовжити читання
У чому полягає користь магнію? Магній — один із найважливіших мікроелементів, який бере участь у сотнях біохімічних процесів. Він впливає на функціонування м’язів, нервової системи, серця та імунітету. Незважаючи на це, дефіцит магнію — поширена …
Продовжити читання
Багато людей хоча б раз у житті стикалися з ситуацією, коли нудить зранку без очевидної причини. Це неприємне відчуття може зіпсувати настрій на весь день, а іноді — вказувати на приховану проблему. У цій статті …
Продовжити читання
Подагра — це хронічне захворювання, що виникає через порушення обміну сечової кислоти в організмі. Її накопичення спричиняє утворення кристалів, які відкладаються у суглобах і спричиняють сильний біль, запалення та набряки. Лікування подагри обов’язково має включати …
Продовжити читання
Папіломи — це дрібні доброякісні новоутворення на шкірі, які з’являються через активізацію вірусу папіломи людини (ВПЛ). Вони можуть виникнути будь-де: на шиї, обличчі, руках, ногах або навіть на повіці. Багатьох турбує питання, як видалити папілому …
Продовжити читання